TECNOLOGÍA MÉDICA HUAREN
CÉLULAS MADRE
Muerte por hierro y la disputa sobre la terapia con células madre mesenquimales


▲Imagen con derechos de autor, por favor no reproducir
01 INTRODUCTION
¿Muerte por hierro? ¿Cuál fue su primer pensamiento? ¿Creía que el hierro también muere? Si lo piensa, está equivocado. La muerte por hierro es un nuevo tipo de muerte celular regulada; este modo único de muerte celular es impulsado por la peroxidación de fosfolípidos dependiente del hierro, regulada por una variedad de eventos metabólicos celulares, y está involucrada en varias vías de señalización relacionadas con el desarrollo de enfermedades. Desde la aparición del término "muerte por hierro" en 2012, la investigación sobre la muerte por hierro ha aumentado exponencialmente en los últimos años, y ha sido reconocida como un punto álgido de investigación de la Fundación Nacional de Ciencias Naturales de China durante años consecutivos. Hoy, me gustaría hablar sobre qué es la muerte por hierro, en qué enfermedades desempeña un papel importante la muerte por hierro, y si las células madre mesenquimales, que han causado sensación en el campo de la terapéutica, también desempeñan un papel significativo en el daño a las enfermedades inducido por la muerte por hierro. Las células madre mesenquimales tienen un efecto inesperado en el daño a la enfermedad inducido por la muerte por hierro.
02 ¿Qué es la muerte por hierro?
La muerte por hierro se define como la muerte regulada y dependiente del hierro causada por la ruptura de la membrana plasmática debido a la peroxidación lipídica sin restricciones [1]. Este proceso se basa en una combinación de metabolitos, especies reactivas de oxígeno (ROS), fosfolípidos de cadenas de ácidos grasos poliinsaturados (PUFA-PL) y el metal de transición hierro [2]. La muerte por hierro puede ser causada por vías extrínsecas o intrínsecas; la vía extrínseca se inicia mediante la inhibición de proteínas de transporte de la membrana celular, como las proteínas de transporte de cisteína/glutamato o la activación de proteínas de transferencia de hierro, transferrina sérica y lactotransferrina; y la vía intrínseca se activa mediante el bloqueo de enzimas antioxidantes intracelulares como la glutatión peroxidasa GPX4 [3]. Además de los compuestos y fármacos de moléculas pequeñas, los eventos de señalización intracelulares e intercelulares y las tensiones ambientales (por ejemplo, altas temperaturas, bajas temperaturas, hipoxia y radiación) pueden inducir la muerte por hierro, y la regulación aberrante de este proceso se ha relacionado con vías de degradación de proteínas (por ejemplo, autofagia y el sistema ubiquitina-proteasoma), que están estrechamente asociadas con una variedad de afecciones patológicas como enfermedades cardiovasculares, inflamación, cáncer y enfermedades neurodegenerativas (Figura 1).

▲Fig. 1 Resumen de la muerte por hierro [2].
03 El papel de la muerte por hierro en las enfermedades cardiovasculares
El mantenimiento de la homeostasis del hierro es fundamental para la función cardíaca normal, y cada vez hay más pruebas de que la muerte por hierro es una característica común de muchos subtipos de enfermedades cardiovasculares, como la miocardiopatía inducida por adriamicina, la lesión por isquemia-reperfusión del miocardio, el infarto de miocardio y la insuficiencia cardíaca [4]. Se ha demostrado que la muerte por hierro durante la isquemia-reperfusión cardíaca promueve la liberación de sustancias endógenas a través de vías de señalización dependientes del receptor tipo Toll 4, causando la adhesión de neutrófilos a las células endoteliales vasculares coronarias, lo que desencadena una respuesta inflamatoria en el corazón donante [5]. En un modelo de ratón de miocardiopatía inducida por diabetes, al examinar la expresión de los reguladores clave de la muerte por hierro, se descubrió que los productos finales de glucosilación tardía, un factor causal importante en la miocardiopatía diabética, inducían la muerte por hierro en tejidos cardíacos diseñados, lo que se manifestó por un aumento de los niveles de PTGS2 y peróxidos lipídicos y una disminución de los niveles de ferritina y SLC7A11 [6]. En un modelo de miocardiopatía inducida por adriamicina, los niveles de hierro cardíaco, los ROS derivados de lípidos y los biomarcadores de muerte por hierro aumentaron significativamente, mientras que la inhibición de la muerte por hierro tuvo un efecto cardioprotector significativo [7]. Además, la muerte por hierro desempeña un papel igualmente importante en el modelo de miocardiopatía séptica inducida por lipopolisacárido, en el que el lipopolisacárido desencadena la miocardiopatía séptica al inducir un aumento en la expresión de SFXN1 en las membranas mitocondriales del miocardio, lo que aumenta la producción de ROS mitocondriales y conduce a la muerte por hierro [8]. En un modelo de ratón de miocardiopatía hipertrófica, la deleción genética de SLC7A11, un regulador clave de la muerte por hierro, exacerba la fibrosis cardíaca, la hipertrofia y la disfunción mediadas por la angiotensina, lo que proporciona evidencia genética de la participación de la muerte por hierro en la miocardiopatía hipertrófica [9].
04 El papel de la muerte por hierro en la inflamación
A diferencia de la apoptosis, que es inmunosilenciada, la muerte por hierro es inmunogénica, y las células afectadas por la muerte por hierro pueden liberar patrones moleculares asociados a daños y alarmas que amplifican la muerte celular y promueven una gama de respuestas relacionadas con la inflamación (Fig. 2). La enfermedad del hígado graso no alcohólico (NAFLD) es una enfermedad hepática grasa grave que se caracteriza por inflamación lobular, acumulación de lípidos en los hepatocitos y degeneración en globo, y en un modelo de ratón, se encontró que los niveles de proteínas de citocinas proinflamatorias (incluidas TNFα, IL-1β e IL-6) estaban significativamente elevados en los tejidos hepáticos al inducir la muerte por hierro, lo que se vio drásticamente mejorado por un inhibidor de la muerte por hierro que redujo la gravedad de la NAFLD [10]. En las dermatosis inflamatorias, el tratamiento de las dermatosis inflamatorias con inhibidores de la muerte por hierro provocó una mejora significativa de la piel y una regulación a la baja de la expresión de GPX4, una regulación al alza de los objetivos posteriores a Nrf2, un aumento de la entrada de hierro intracelular y una regulación a la baja de la expresión del factor inflamatorio IL-22 [11]. Además, en el modelo de lesión renal aguda (AKI) inducida por ácido oxálico en ratones, un inhibidor de la muerte por hierro suprimió la infiltración de neutrófilos y la expresión de las citocinas proinflamatorias CXCL-2 e IL-6 [12]. Recientemente, se ha descubierto que el daño cerebral secundario causado después de una hemorragia cerebral está relacionado con la muerte por hierro, y la muerte por hierro en el cerebro puede causar respuestas inflamatorias en un modelo de rata de hemorragia cerebral, mientras que el tratamiento con un inhibidor de la muerte por hierro puede reducir significativamente los niveles de ROS y factores inflamatorios como IL-1β y TNFα, reducir la inflamación y mejorar la función neuronal en ratas con lesión por hemorragia cerebral [13]. En un modelo de ratón de fibrosis pulmonar inducida por radiación, el inhibidor de la muerte por hierro redujo significativamente la expresión de TNFα, IL-6, IL-10 y TGF-β1 y bloqueó la fibrosis pulmonar inducida por radiación al activar el eje de señalización Nrf2/HO-1 [14].
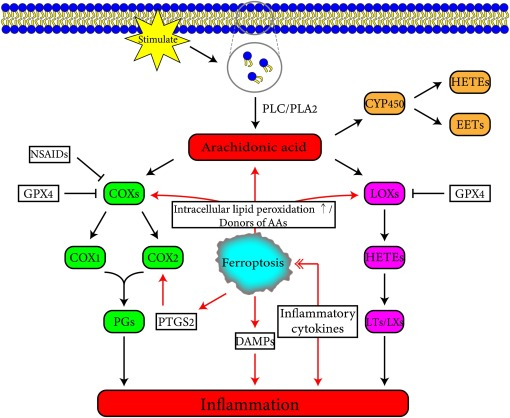
▲Fig. 2 Interacción entre la muerte por hierro y la inflamación [15]
05 Papel de la muerte por hierro en el cáncer
En la última década, muchos estudios han demostrado que la muerte por hierro está asociada con el desarrollo de varios tipos de tumores y la respuesta al tratamiento, y puede desencadenar inmunosupresión asociada a la inflamación en el microambiente tumoral, favoreciendo así el crecimiento tumoral [16]. En los tejidos tumorales de pacientes con cáncer ovárico plasmocitoides, se encontró que la proteína de transporte de hierro (FPN) estaba disminuida y que el receptor de transferrina (TFR1) estaba aumentado, y el tratamiento con inductores de muerte por hierro inhibió el crecimiento tumoral y la diseminación intraperitoneal de células tumorales in vivo [17]. Otro estudio informó que la cilazina y el lapatinib indujeron sinérgicamente la muerte de células de cáncer de mama mediada por muerte por hierro al aumentar la producción de ROS dependiente del hierro [18]. El tratamiento con cisplatino induce la muerte por hierro al reducir el agotamiento del glutatión y la inactivación de la glutatión peroxidasa en las células de cáncer de pulmón, en las que la combinación de cisplatino e inductores de muerte por hierro aumentó significativamente la actividad antitumoral [19]. Además, se ha informado que dosis bajas de inductores de muerte por hierro pueden aumentar significativamente la capacidad de la adriamicina y la citarabina para matar células de leucemia mieloide aguda al estimular la apoptosis necrótica y la muerte por hierro [20].
06 Las células madre mesenquimales mitigan la progresión de la enfermedad al inhibir la muerte por hierro
Las células madre mesenquimales (MSC) tienen una alta capacidad de autorrenovación, un potencial de diferenciación multilineal y propiedades inmunomoduladoras, y estas características únicas las convierten en una poderosa herramienta para la investigación y las aplicaciones clínicas. En la lesión hepática aguda, el tratamiento con MSC y exosomas derivados (MSC-Exo) logró la remisión patológica e inhibió la producción de peroxidación lipídica, disminuyó los niveles de ARNm de sintasa peroxisomal 2 y lipooxigenasa en hepatocitos primarios e hígados de ratón, restauró los niveles de proteína SLC7A11 y previno la muerte por hierro inducida por CCl4 en los hepatocitos [21]. En un modelo de ratón de infarto agudo de miocardio, la muerte por hierro ocurre en los cardiomiocitos después de una lesión isquémica e hipóxica, mientras que los exosomas de MSC derivados de sangre de cordón umbilical humano pueden atenuar la lesión miocárdica al inhibir la muerte por hierro en ratones con infarto agudo de miocardio [22]. La muerte por hierro también juega un papel importante en el desarrollo de la fibrosis hepática, y la activación de las células estrelladas hepáticas puede causar fibrosis hepática, y las MSC del cordón umbilical humano y sus exosomas secretados pueden reducir la activación de las células estrelladas hepáticas y atenuar la fibrosis hepática en modelos animales al promover la muerte por hierro desencadenada por la formación de ROS en las células estrelladas hepáticas humanas, la disfunción mitocondrial, la liberación de Fe2+ y la peroxidación lipídica [23].
▲Células madre mesenquimales de médula ósea (imagen con derechos de autor, por favor no reproducir)
Se ha demostrado que la muerte por hierro está asociada con la fisiopatología de la lesión cerebral traumática y que los niveles de biomarcadores relacionados con la muerte por hierro en los tejidos de la lesión cerebral traumática leve repetitiva mostraron alteraciones dependientes del tiempo, como metabolismo anormal del hierro, inactivación de la glutatión peroxidasa (GPX), disminución de los niveles de GPX4 y aumento de la peroxidación lipídica, mientras que el tratamiento con MSC redujo significativamente las alteraciones mediadas por la lesión cerebral traumática leve repetitiva mencionadas anteriormente, el daño neuronal, la deposición de proteínas patológicas y mejoró la función cognitiva [24]. La lesión hepática aguda se caracteriza por una disfunción metabólica grave causada por un daño extenso de los hepatocitos, y los experimentos in vivo e in vitro han demostrado que el tratamiento con exosomas de MSC inhibe la muerte por hierro inducida por especies reactivas de oxígeno y peroxidación lipídica en los tejidos hepáticos, y atenúa significativamente la lesión hepática inducida por D-galactosamina y lipopolisacárido [25]. En el modelo de paro cardíaco porcino, el nivel de expresión de ACSL4 y el nivel de depósito de hierro del corazón de todos los animales resucitados aumentaron significativamente, y el nivel de expresión de GPX4 disminuyó significativamente, lo que desencadenó la muerte por hierro, y el tratamiento de MSC redujo significativamente la muerte por hierro después de la reanimación del paro cardíaco y alivió significativamente la lesión cardíaca postratamiento en cerdos [26]. Las trampas extracelulares de neutrófilos (NET) juegan un papel importante en la formación de aneurismas de aorta abdominal, y las trampas extracelulares de neutrófilos promueven la formación de aneurismas de aorta abdominal al inducir la muerte por hierro en las células del músculo liso mediante la inhibición de la vía PI3K/AKT. En un modelo de ratón, los exosomas de MSC alivian la muerte por hierro al disminuir la liberación de trampas extracelulares de neutrófilos a través de su regulación inmunitaria y capacidad regenerativa, atenuando la formación de aneurismas de aorta abdominal [27].
07 Summarize
La muerte por hierro es una nueva forma no apoptótica de muerte celular regulada que se caracteriza por una acumulación masiva de peróxidos lipídicos que desencadena una variedad de enfermedades. En el futuro, la muerte por hierro puede encontrarse en más y más enfermedades y desempeñar un papel importante en el proceso fisiopatológico, y el estudio de los objetivos terapéuticos de las enfermedades desde la perspectiva de la muerte por hierro puede proporcionar nuevas soluciones clínicas para el tratamiento de las enfermedades. En la actualidad, se han realizado muchos estudios clínicos sobre la terapia con MSC en China, y los estudios confirmaron que las MSC también juegan un papel importante en el daño de la enfermedad inducido por la muerte por hierro, y se cree que en un futuro próximo, las terapias con células madre desempeñarán un papel más importante en el tratamiento de las enfermedades de una manera sorprendente.
Más conocimiento


