16
2023
--
08
Principios de la inmunoterapia celular - CAR-T
En las últimas décadas, la investigación científica sobre el mecanismo antitumoral de las células inmunitarias ha experimentado un rápido desarrollo, y la terapia celular adoptiva (ACT) se ha convertido en el método más prometedor para curar el cáncer. La terapia ACT se refiere al método de recolección de la sangre del paciente, aislamiento de las células inmunitarias in vitro, y reinfusión en el cuerpo del paciente mediante modificación, proliferación, cultivo e identificación para lograr el propósito de tratar el cáncer. La terapia ACT incluye principalmente TIL, CAR-T, TCR-T, etc. La CAR-T (terapia con anticuerpos quiméricos) es el método más prometedor para tratar el cáncer.

01 Introduction
En las últimas décadas, la investigación científica sobre el mecanismo antitumoral de las células inmunitarias ha experimentado un rápido desarrollo, y la terapia celular adoptiva (ACT) se ha convertido en el método más prometedor para curar el cáncer. La terapia ACT se refiere al método de recolección de la sangre del paciente, aislamiento de las células inmunitarias in vitro, e infusión de nuevo en el cuerpo del paciente mediante modificación, proliferación, cultivo e identificación para lograr el propósito de tratar el cáncer. La terapia ACT incluye principalmente TIL, CAR-T, TCR-T, etc. CAR-T (terapia de anticuerpos quiméricos) es el método más prometedor para tratar el cáncer.
La terapia CAR-T (célula T con receptor de antígeno quimérico, CAR-T), es decir, la terapia con células T con receptor de antígeno quimérico, es uno de los métodos más nuevos y prometedores para el tratamiento del cáncer en la actualidad, que puede mejorar el sistema inmunitario del cuerpo para combatir el cáncer. La terapia CAR-T, por medio de la ingeniería genética, quimériza un cierto gen receptor de antígeno tumoral específico en la membrana celular de los linfocitos T para formar un gen receptor de antígeno tumoral modificado. gen receptor de antígeno en la membrana celular de los linfocitos T para formar linfocitos T modificados, que a su vez pueden reconocer y unirse específicamente a los antígenos en la superficie de las células tumorales para lograr la eliminación específica de las células tumorales (Figura 1). A diferencia de los linfocitos T, la estructura CAR de las células CAR-T reconoce los antígenos en la superficie de las células tumorales y dirige a los linfocitos T a realizar funciones citotóxicas sin depender de las moléculas MHC (complejo mayor de histocompatibilidad), por lo que las células CAT-T tienen un rango de objetivos más amplio que los linfocitos T naturales.
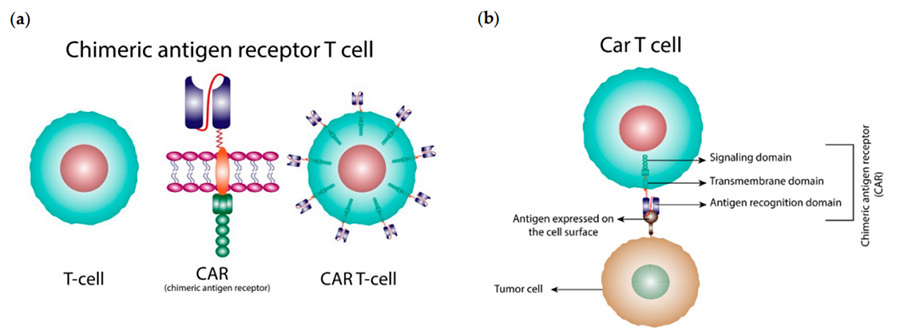
▲Figura 1: Diagrama esquemático de CAT-T [1].
CAR es un receptor de proteína que se dirige a antígenos, que puede fusionarse con los linfocitos T y reconocer específicamente los antígenos en las células tumorales. El diseño de la estructura CAR es clave para la terapia CAR-T. Una estructura CAR típica consta de tres partes principales: el dominio extracelular, el dominio transmembrana y el dominio intracelular (Figura II).
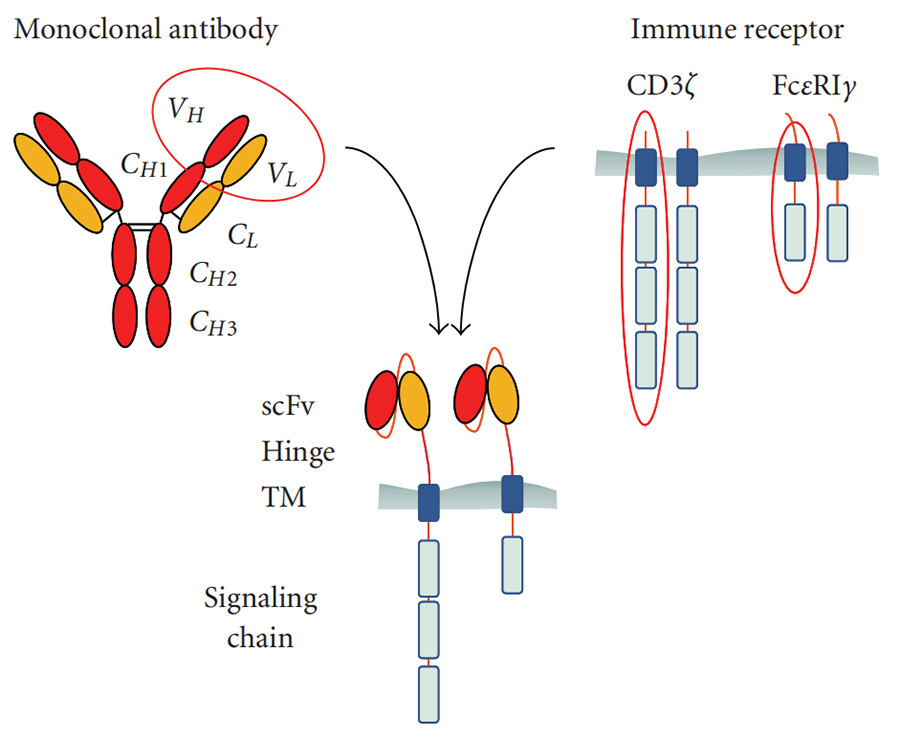
▲Figura 2: Estructura del receptor de antígeno quimérico (CAR) [2]
Los dominios extracelulares son el fragmento variable de cadena única, scFv, y el dominio bisagra del anticuerpo monoclonal. scFv es responsable de reconocer y unirse al antígeno asociado a tumor (TAA) en la superficie de las células tumorales. La bisagra es responsable de conectar scFv al dominio estructural transmembrana (TM).
El dominio transmembrana es responsable de anclar la estructura CAR a la membrana de los linfocitos T y tiene un efecto estabilizador en la estructura CAR, y hay evidencia de que también mejora la activación de los linfocitos T [3].
El dominio intracelular consta de dos partes, el dominio estructural de activación de señalización (SASD) y uno o más dominios estructurales coestimuladores (CSD). El dominio de señalización es responsable de la activación de los linfocitos T, y esta estructura suele ser CD3ζ. El proceso de activación de los linfocitos T depende de la fosforilación del motivo de activación de aminoácidos del complejo inmunorreceptor (ITAM) en CD3ζ. Además de CD3ζ, algunos estudios han utilizado el receptor Fc de la inmunoglobulina (Ig) E-γ dominio estructural como dominio estructural de activación de señal para CAR, pero han encontrado que esta estructura es menos efectiva. Sin embargo, confiar solo en CD3ζ en el dominio estructural de activación de señal no es suficiente para activar los linfocitos T hasta cierto nivel y mantener la proliferación de células CAR-T. El dominio estructural coestimulador (que falta en CAR-T de primera generación) generalmente se origina en las subunidades de señalización de los linfocitos T, como de la familia de receptores CD28 (CD28, ICOS) o de la familia de receptores del factor de necrosis tumoral (4-1BB, OX40, CD27), y su función es conducir las señales de unión extracelulares a los linfocitos T, iniciar reacciones en cascada de señalización descendentes, proporcionar una segunda señal para la activación de los linfocitos T que permite que los linfocitos T proliferen continuamente y liberen citocinas para mejorar la capacidad antitumoral de los linfocitos T.
En resumen, cada una de las tres partes de la estructura CAR realiza su propia función. scFv actúa como un reconocedor de antígenos, que puede reconocer y unirse a las células diana; el dominio estructural transmembrana es equivalente al "andamio" del CAR, que fija firmemente la estructura CAR a los linfocitos T; el dominio estructural de activación de señal y el dominio estructural coestimulador trabajan juntos para activar los linfocitos T, proliferar y guiar su eliminación. El dominio de activación de señal y el dominio coestimulador juntos activan los linfocitos T, proliferan y los guían para eliminar las células tumorales, y al mismo tiempo inducen a las células inmunitarias endógenas a eliminar las células tumorales. Tras el reconocimiento y la unión del antígeno, se genera una señal estimulatoria que se transmite al dominio de señalización intracelular, y los linfocitos T se activan y funcionan.
03 Evolución de las diferentes generaciones de CAR-T
Después de casi tres décadas de desarrollo e innovación tecnológica continua, CAR se encuentra ahora en su quinta generación, que tiene como objetivo mejorar la seguridad de la terapia al reducir la toxicidad y el reconocimiento de antígenos no específicos, aumentar la eficiencia al estimular la proliferación, la activación y la generación de fenotipos de memoria en las células CAR-T, y proporcionar inmunomodulación para una acción óptima de las células CAR-T (Figura III).
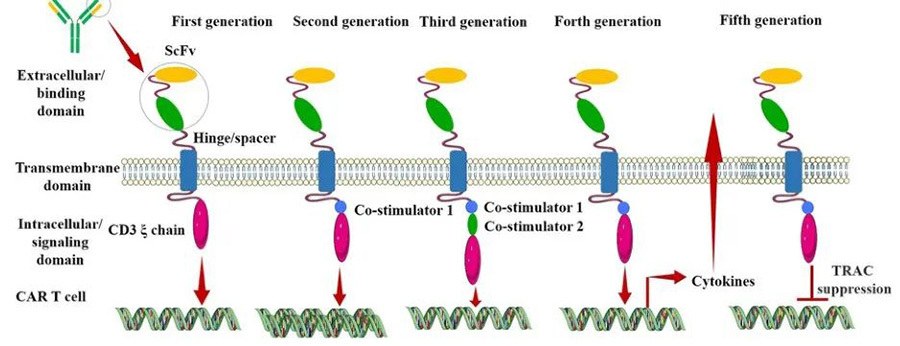
▲Figura 3; Evolución de la estructura CAR a lo largo de las generaciones [4]
CAR de primera generación
La estructura CAR de primera generación tiene scFv extracelular como dominio estructural de unión de reconocimiento de antígeno y CD3ζ intracelular como dominio estructural de activación de señalización intracelular. Aunque el CAR-T de primera generación podría iniciar respuestas antitumorales citotóxicas en los linfocitos T trasplantados, la estructura CAR no pudo producir niveles suficientes de interleucina (IL)-2 debido a la falta de un dominio estructural coestimulador, lo que resultó en bajos niveles de citotoxicidad y proliferación de linfocitos T.
CAR de segunda generación
Basándose en el dominio de señalización CD3ζ, la segunda generación de CAR agregó un dominio estructural de señalización coestimulador capaz de activar los linfocitos T, lo que mejoró enormemente la proliferación y el tiempo de supervivencia de los linfocitos T. Por ejemplo, CD28 puede entregar una señal de activación muy fuerte, que puede permitir que los linfocitos T alcancen un alto nivel de actividad de eliminación en un período de tiempo relativamente corto; 4-1BB entrega una señal de activación más persistente, que puede permitir la eliminación sostenida de células tumorales por parte de los linfocitos T. Sin embargo, debido al hecho de que las células CAR-T de segunda generación utilizan retrovirus como vectores infecciosos, la longitud de los fragmentos de transgenes que pueden transportar es limitada, y no pueden transferir simultáneamente tanto CD28 como 4-1BB a los linfocitos T al mismo tiempo, por lo que solo pueden elegir entre los dos.
CAR de tercera generación
La tercera generación de CAR-T utiliza lentivirus con mayores cargas de ADN como vectores infecciosos, por ejemplo, los fragmentos de ADN de CD28 y 4-1BB se pueden introducir en los linfocitos T al mismo tiempo, por lo que la tercera generación de la estructura CAR contiene dos dominios estructurales coestimuladores, lo que teóricamente resuelve el problema de una mayor intensidad de activación de CAR-T y una mayor capacidad de supervivencia. Sin embargo, todavía no hay una buena solución para los problemas de seguridad causados por el alto nivel de persistencia de CAR-T que puede provocar su ataque al sistema autoinmune.
CAR de cuarta generación
La cuarta generación de CAR está diseñada desde la perspectiva del tratamiento de precisión de las enfermedades oncológicas. Por ejemplo, los tumores sólidos en el proceso de desarrollo crónico crearán un microambiente (TME), lo que resulta en que CAR-T no puede ingresar al tumor, por lo que la terapia CAR-T en el tratamiento de tumores sólidos no ha sido muy efectiva. TRUCK CAR-T introducirá citocinas (IL-12) o quimiocinas en el CAR, puede aumentar la infiltración de linfocitos T en los tejidos tumorales y, al mismo tiempo, reclutar otras células inmunitarias del cuerpo para eliminar las células tumorales; en algunos casos, el CAR se utilizará para el tratamiento de células tumorales; en algunos casos, el CAR puede atacar el sistema inmunitario del propio cuerpo, lo que puede provocar problemas de seguridad. Las células tumorales se eliminan; en algunos estudios, se adjunta un gen suicida o un gen sensible a ciertas drogas a la estructura CAR para asegurar que el CAR-T pueda eliminarse del cuerpo después del tratamiento sin dañar accidentalmente las células normales del cuerpo, mejorando la seguridad y la controlabilidad de la terapia CAR-T.
CAR de Quinta Generación
El CAR-T de quinta generación es un CAR-T de propósito general, que evita la aparición de la respuesta de injerto contra huésped (GVHD) al eliminar el gen TRAC, lo que conduce a la eliminación de las cadenas α (TCR-α) y β (TCR-β) del receptor de células T, lo que implica que se eliminan los receptores de células T (TCR) en la superficie de las células T.
04 Summary
Desde que la FDA aprobó el producto CD19 CAR-T de Novartis (Kymriah) en el mercado en 2017, la terapia con células CAR-T ha entrado en una fase de rápido desarrollo, pero los productos actualmente aprobados en el mercado son todos CAR-T de segunda generación. Todavía queda un largo camino por recorrer para que la terapia CAR-T se popularice en el mercado.
La seguridad es el primer problema que debe abordarse con la terapia CAR-T, como el efecto fuera del objetivo, el síndrome de liberación de citoquinas (SRC) y la neurotoxicidad (NTX); los productos CAR-T actualmente comercializados se centran en el tratamiento de tumores hematológicos, mientras que el tratamiento de tumores sólidos aún no ha logrado un gran avance. En 2021, la NMPA de China aprobó la inyección de Argirenzai de Fosun Kate y la inyección de Ruigi Orenzai de WuXi Juno. Ambos productos CAR-T se dirigen a CD19. Aunque el CAR-T dirigido a CD19 es muy eficaz, sólo se limita al tratamiento de tumores hematológicos relacionados con las células B, y es necesario desarrollar objetivos más específicos para abordar el tratamiento de tumores sólidos; el precio elevado también es un gran desafío para la terapia CAR-T, como 1,2 millones de RMB por inyección para la inyección de Alkirenzai y 1,2 millones de RMB por inyección para la inyección de Rigiorenzai. El elevado precio también supone un gran reto para la terapia CAR-T, como 1,2 millones de RMB para la inyección de Argirenzide y 1,29 millones de RMB para la inyección de Rigiorenzide, lo que hace que la mayoría de los pacientes con cáncer se muestren reacios a tomarla.


