25
2023
--
08
Principios de la Terapia Celular Transdérmica - TCR-T
Recientemente, Cell Reports Medicine, una revista internacionalmente reconocida, publicó los resultados de la investigación clínica de Fase I de TAEST16001, el primer producto de terapia TCR-T en China [1]. TAEST16001 se utiliza para el tratamiento del sarcoma de tejidos blandos avanzado, lo que constituye un paso clave hacia la traducción clínica de ACT en el campo de los tumores sólidos y, una vez más, encendió la confianza de la gente en el tratamiento de tumores sólidos con terapias TCR-T. En esta edición, hablemos de los detalles de la terapia TCR-T.

01 Preface
Recientemente, Cell Reports Medicine, una revista de renombre internacional, publicó los resultados de la investigación clínica de fase I de TAEST16001, el primer producto de terapia TCR-T en China [1]. TAEST16001 se utiliza para el tratamiento del sarcoma de tejidos blandos avanzado, lo que constituye un paso clave hacia la traducción clínica de ACT en el campo de los tumores sólidos y, una vez más, encendió la confianza de la gente en el tratamiento de tumores sólidos con terapias TCR-T. confianza en la terapia TCR-T para tumores sólidos. En este artículo, hablemos de los pormenores de la terapia TCR-T.
El microambiente tumoral (TME) de los tumores sólidos es rico en estroma microscópico y células inmunosupresoras, que pueden proteger el tejido tumoral contra el ataque de las células inmunitarias. En el microambiente del cáncer de páncreas, por ejemplo, los niveles aumentados de ácido hialurónico (HA) impiden la infiltración de células inmunitarias. Los receptores del punto de control inmunitario en las células tumorales o las células inmunosupresoras pueden inhibir las células T uniéndose a ligandos reguladores negativos en las células T. Y en este microambiente tumoral, que carece de aminoácidos esenciales y tiene poco oxígeno, las células T se vuelven senescentes y se agotan. Por lo tanto, no existe una cura para los tumores sólidos, y su progresión solo se puede controlar por diversos medios. Aunque la terapia con células T con receptor de antígeno quimérico (CAR-T) ha logrado grandes avances en los tumores hematológicos, todavía no hay un gran avance en el tratamiento de los tumores sólidos. Como resultado, los investigadores han puesto sus esperanzas en una cura para los tumores sólidos en TCR-T, un enfoque alternativo a la terapia celular de venta libre (ACT).
02 ¿Qué es la terapia TCR-T
La terapia con células T con receptor de células T quiméricas (TCR-T) se basa en la misma idea que la CAR-T, donde se obtienen células T modificadas capaces de reconocer específicamente antígenos mediante la modificación de las células T in vitro, y las células T expresadas finalmente son capaces de dirigirse y eliminar las células tumorales para el tratamiento del cáncer [2] (Figura 1).
Ideas terapéuticas:
(1) Se extrae suficiente sangre del paciente para obtener células mononucleares periféricas (PBMC);
(2) Aislamiento y purificación de células T de PBMC;
(3) Cultivo in vitro para expandir las células T;
(4) Introducción de fragmentos de genes TCR o CAR que se modificarán en células T (a través de vectores virales como lentivirus y retrovirus);
(5) Después de la expansión continua y el control de calidad, el TCR-T/CAR-T modificado se infunde de nuevo en el paciente.
A diferencia de las terapias CAR-T, que reconocen los antígenos de la superficie celular tumoral a través de la estructura CAR, las terapias TCR-T se basan en la unión de los receptores de células T (TCR) a los antígenos intracelulares presentados por los MHC para reconocer las células tumorales. Para comprender el mecanismo de TCR-T, es importante comprender la estructura y el mecanismo de funcionamiento del complejo mayor de histocompatibilidad (MHC) y el receptor de células T (TCR).
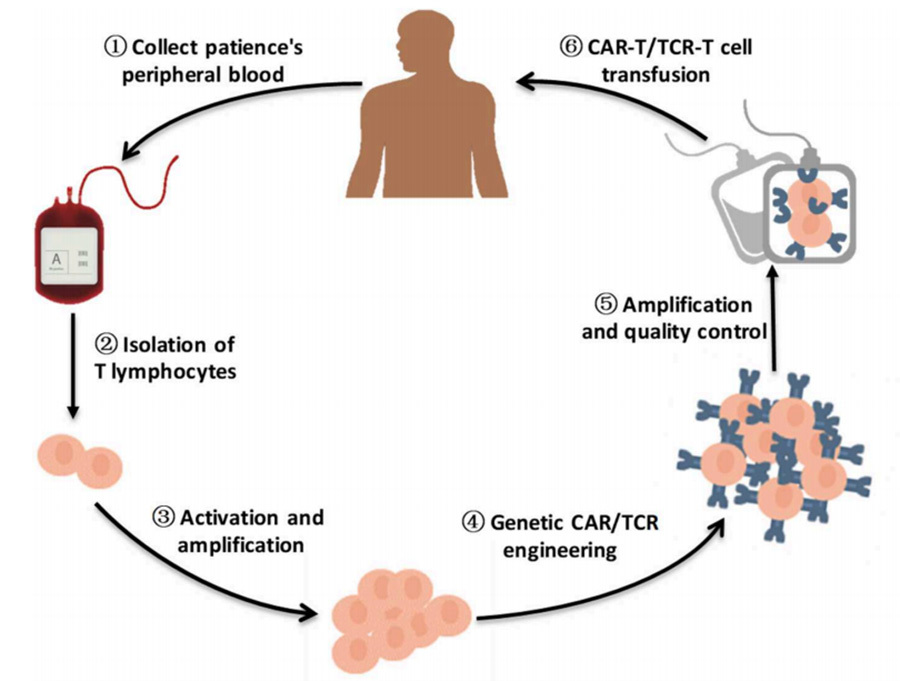
▲Figura 1. Diagrama de flujo breve de la terapia con células T modificadas
03 Estructura y función del MHC
Existen dos tipos de MHC, MHC-I y MHC-II, codificados por el locus del antígeno leucocitario humano (HLA) en el brazo corto del cromosoma 6 humano, que se expresan en diversos grados en la superficie celular. Entre ellos, HLA-A, HLA-B y HLA-C codifican moléculas de tipo I MHC-I, y HLA-DR, HLA-DQ y HLA-DP codifican moléculas de tipo II MHC-II [3] (Fig. 2). Los genes HLA desempeñan un papel muy importante en el sistema inmunitario, y el sistema inmunitario humano distingue entre las células propias y las ajenas mediante los productos codificados por los genes HLA. Las discrepancias entre los genes HLA de un donante de órganos y los genes HLA entre los pacientes suelen provocar un rechazo inmunitario.
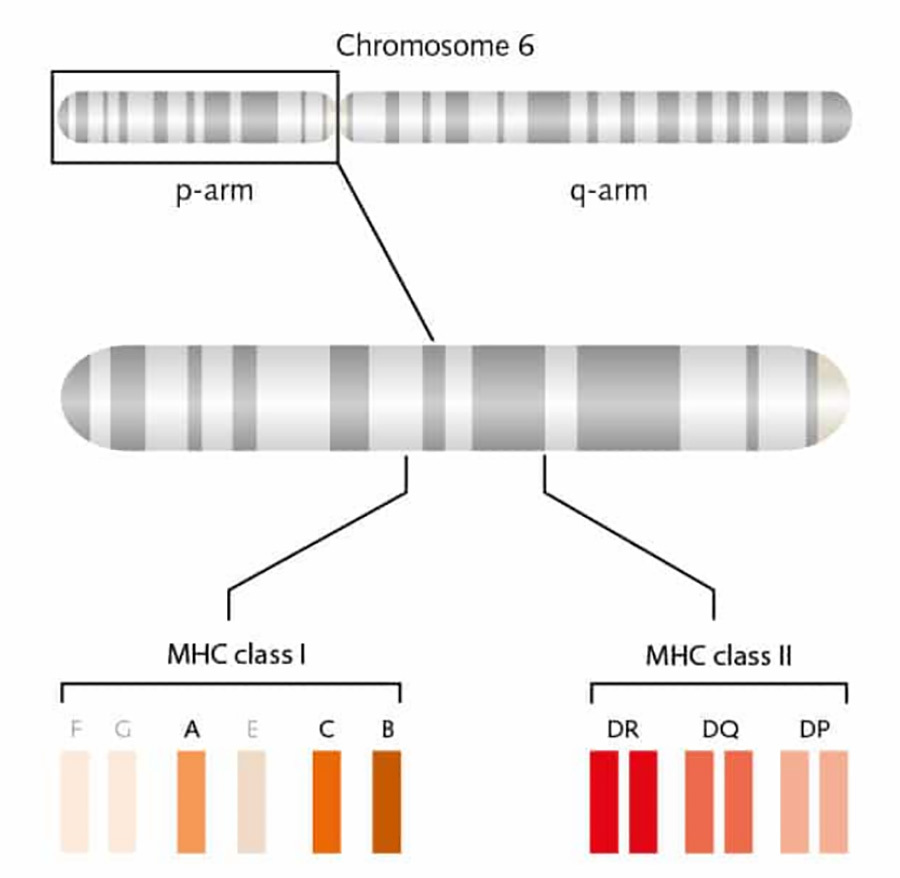
▲Figura 2. Representación esquemática del locus HLA humano
El MHC-I es responsable de la presentación de moléculas de señalización de antígenos endógenos, se expresa en la superficie de casi todas las células nucleadas y consta de una cadena α y una β-globina, donde los dominios α1 y α2 forman una hendidura, que es la hendidura de unión a péptidos, que permite que los fragmentos de polipéptidos antigénicos se unan y se presenten en la superficie de la membrana celular. El MHC-II es responsable de la presentación de moléculas de señalización exógenas, y se expresa en la superficie de las células presentadoras de antígenos (APC), como monocitos-macrófagos, células dendríticas y células B. El MHC-II es responsable de la presentación de moléculas de señalización exógenas y se expresa en la superficie de las células presentadoras de antígenos (CPA), como monocitos-macrófagos, células dendríticas y células B. El MHC-II consta de dos cadenas, α y β, donde la hendidura formada entre α1 y β1 participa en la unión de fragmentos de polipéptidos antigénicos [4] (Figura III).
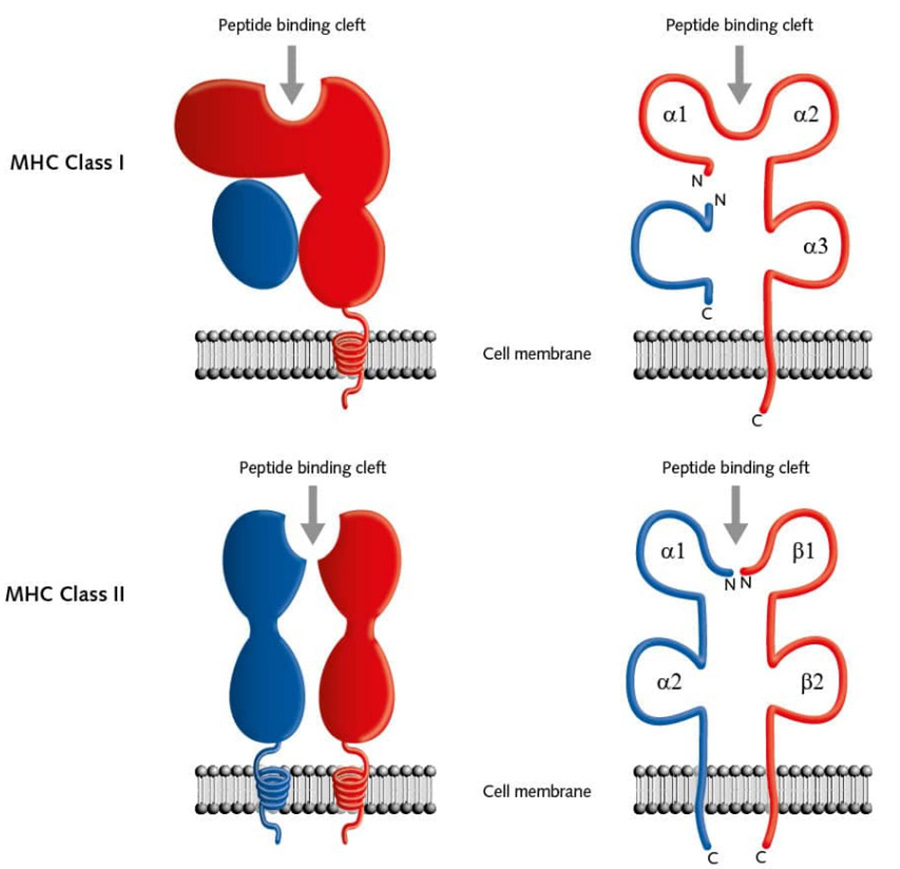
▲Figura 3. Estructura esquemática del MHC (HLA)
Los antígenos endógenos son proteínas producidas por la propia célula, como las cápsides proteicas sintetizadas utilizando células huésped después de una infección viral o las proteínas tumorales de lesiones cancerosas. Dentro de la célula, estas proteínas endógenas forman péptidos de pequeñas moléculas cuando son procesadas por sus propias células, que luego se unen al MHC-I para formar el complejo pMHC-I y se presentan en la superficie de la membrana celular para unirse a las células T CD8+, que median la apoptosis o la muerte celular programada (Fig. 4, izquierda).
Cuando los antígenos no son sintetizados endógenamente por la célula, sino que invaden desde el exterior, como en el caso de infecciones bacterianas u fúngicas, las células APC los incorporan a la célula mediante fagocitosis y los digieren en pequeños fragmentos de moléculas antigénicas de cadenas peptídicas. Las moléculas antigénicas resultantes se unen al MHC-II para formar el complejo pMHC-II y se presentan en la superficie de la membrana celular, donde el complejo pMHC-II se unirá a las células T CD4+ para generar una serie de columnas de respuestas inmunitarias para eliminar el antígeno (Fig. 4 derecha).
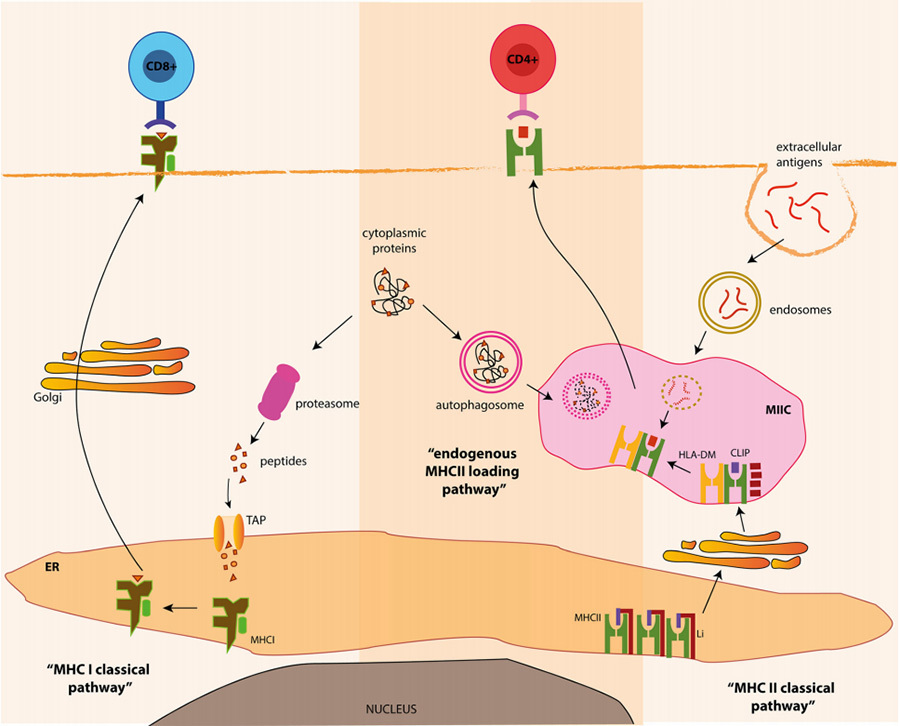
▲Figura 4 Diagrama de la vía clásica del MHC [5]
04Estructura y función del TCR
Mediante la introducción anterior, entendemos que el reconocimiento de antígenos por TCR-T depende de que el MHC presente moléculas de antígenos intracelulares en la superficie de la membrana celular, por lo que el MHC es un componente esencial para la función de TCR-T. El complejo TCR, es otro componente importante de TCR-T. Para activar los linfocitos T, el complejo TCR debe interactuar con el complejo MHC portador de antígeno (pMHC).
El TCR utilizado para modificar genéticamente el TCR-T consta de heterodímeros de cadenas α y β, que son estructuras necesarias para que el TCR se una al pMHC, pero esto no es suficiente para causar la activación de las células T. La activación de las células T depende de la señalización de la molécula CD3, que consta de dos heterodímeros, CD3ε y CD3δ, CD3ε y CD3γ, y un homodímero, CD3ζ (La activación de las células T por CD3 depende de la fosforilación del motivo de activación de aminoácidos del complejo inmunorreceptor (ITAM) de cada subunidad (Figura 5).
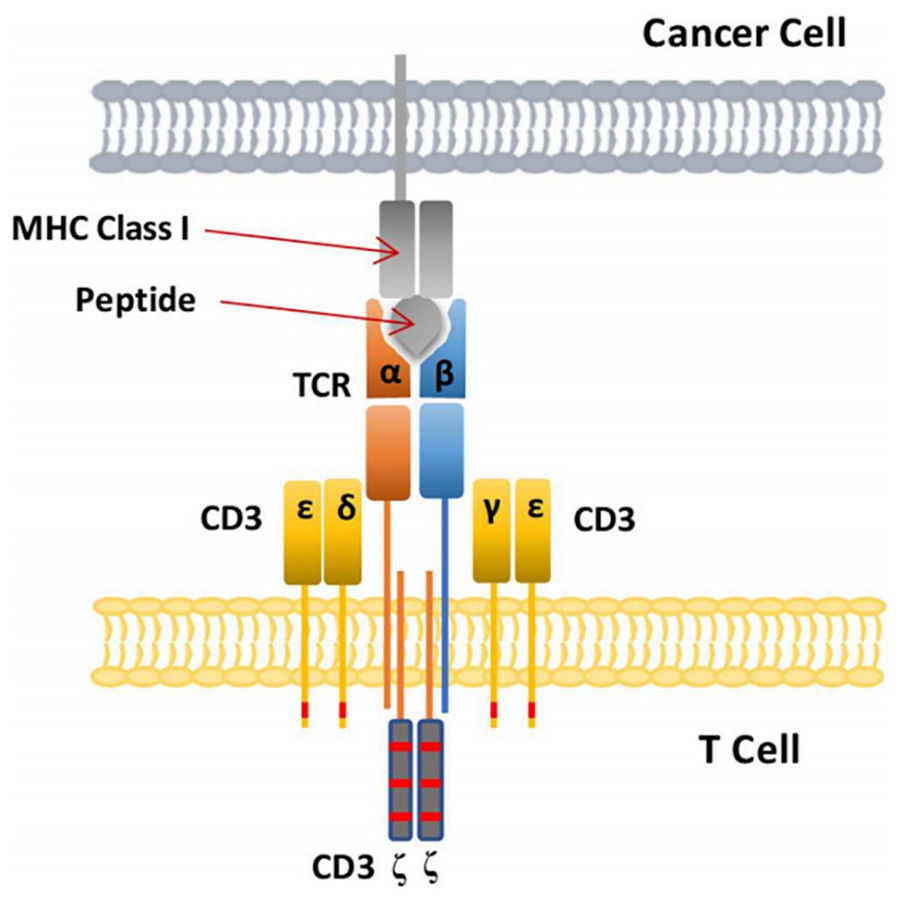
▲Figura V. Representación esquemática de la unión de TCR a pMHC en células tumorales [2]
05 TCR y CAR
Las células TCR-T y CAR-T son ambas células T genéticamente modificadas con la capacidad de identificar y eliminar tumores específicamente, y luego se infunden de nuevo en el cuerpo con el propósito de tratar el cáncer. Los antígenos diana reconocidos por CAR-T son proteínas de la superficie celular, y el número de estas proteínas diana es limitado. Las TCR-T pueden reconocer fragmentos de polipéptidos intracelulares entregados por moléculas MHC, y por lo tanto, el rango de antígenos diana para TCR-T es mucho más amplio. El núcleo de la tecnología TCR-T es modificar la unión del TCR a los antígenos tumorales, para lo cual el TCR natural en el cuerpo humano tiene una afinidad relativamente baja y, por lo tanto, no puede reconocer ni matar las células tumorales. Los TCR de alta afinidad diseñados artificialmente mejoran el reconocimiento específico y la afinidad en el reconocimiento de las células tumorales.
Sin embargo, la terapia TCR-T está limitada a las células MHC y depende de la presentación de las moléculas MHC para reconocer y activar las células T, lo que es una desventaja de TCR-T. El MHC está codificado por el gen HLA, que es el gen más polimórfico del genoma humano, y se ha estimado que hasta la fecha se han identificado más de 20.000 alelos humanos HLA I. Los pacientes que se someten a terapia TCR-T no solo deben expresar el antígeno diana, sino también el antígeno del alelo HLA correspondiente. Como resultado, la terapia TCR-T generalmente utiliza TCR que se limitan a alelos HLA relativamente comunes.
06 Outlook
El 25 de enero de 2022, la Administración de Alimentos y Medicamentos (FAD) aprobó la comercialización del primer producto de terapia TCR-T del mundo, que es Kimmtrak de Immunocore (tebentafusp-tebn, IMCgp100) para pacientes adultos con melanoma uveal irresecable o metastásico (mUM) que es HLA-A*02:01 positivo. Este es un gran avance para la terapia celular de venta libre en tumores sólidos. Empresas nacionales como WuXi Juno, Fosun Kite y Xiangxue Life Sciences también han realizado diseños relevantes en la terapia TCR-T. TAEST16001 es un producto desarrollado por Xiangxue Life Sciences, que actualmente se encuentra en ensayos clínicos de fase II. La TCR-T todavía enfrenta muchos desafíos en el tratamiento oncológico, como la necesidad de identificar más antígenos específicos de células tumorales y TCR reconocidos, y cómo mejorar su relación con los antígenos mediante la modificación del TCR para mejorar su reconocimiento específico y afinidad por los antígenos y otros problemas que aún necesitan más investigación. En cualquier caso, la terapia celular representada por TCR-T ha demostrado sus grandes ventajas en la terapia tumoral y es una tecnología clave para resolver el cáncer.


