11
2023
--
09
Un enfoque de focalización activa para el tratamiento del osteosarcoma con sistemas de nanodelivery
El osteosarcoma es el tumor óseo in situ más común, representando aproximadamente el 35% de las neoplasias malignas óseas. Los principales síntomas de los pacientes con osteosarcoma incluyen movilidad restringida, hinchazón, dolor intenso y fractura patológica, y aproximadamente del 10% al 20% de los pacientes presentan metástasis en el momento de su consulta inicial. El tratamiento convencional incluye la resección quirúrgica temprana y la quimioterapia adyuvante, pero una mayor proporción de pacientes aún responde mal al tratamiento. Los agentes quimioterapéuticos de primera línea actuales incluyen adriamicina, cisplatino y metotrexato, que ejercen sinérgicamente efectos antitumorales a través de diferentes mecanismos de acción, pero debido a la falta de selectividad de estos agentes y a la toxicidad sistémica más pronunciada cuando se aplican en dosis altas, es necesario explorar nuevos enfoques terapéuticos.

01 Osteosarcoma
El osteosarcoma es el tumor óseo in situ más común, representando aproximadamente el 35% de las neoplasias malignas óseas. Los principales síntomas de los pacientes con osteosarcoma incluyen movilidad restringida, hinchazón, dolor intenso y fractura patológica, con aproximadamente un 10-20% de los pacientes que presentan metástasis en el momento de su consulta inicial. El tratamiento convencional incluye la resección quirúrgica temprana y la quimioterapia adyuvante, pero una mayor proporción de pacientes aún responde mal al tratamiento. Los agentes quimioterapéuticos de primera línea actuales incluyen adriamicina, cisplatino y metotrexato, que ejercen sinérgicamente efectos antitumorales a través de diferentes mecanismos de acción. Sin embargo, debido a la falta de selectividad de estos agentes y a la toxicidad sistémica más pronunciada cuando se administran en dosis altas, es necesario explorar nuevos enfoques terapéuticos.
El microambiente tumoral especial del osteosarcoma actúa como una barrera protectora que dificulta gravemente la administración eficaz de fármacos. En primer lugar, el osteosarcoma presenta una gran heterogeneidad histológica e inestabilidad genómica. La secuenciación del genoma completo ha demostrado que el osteosarcoma tiene un genoma altamente anormal con supresores tumorales alterados, y las terapias dirigidas basadas en características genéticas tienen efectos limitados. En segundo lugar, la densa matriz ósea contiene una gran cantidad de minerales inorgánicos, que inhibirían la penetración y la acumulación de agentes quimioterapéuticos en el tumor óseo, y la barrera hemato-medular también impediría el paso de los agentes quimioterapéuticos. Por último, la falta de una diana eficaz a menudo conduce a una acumulación ineficaz de agentes quimioterapéuticos en el sitio del osteosarcoma.
02 Sistemas de administración de fármacos nanodirigidos
En las últimas décadas, la nanotecnología ha demostrado su superioridad en el campo de la medicina, y los sistemas de administración de fármacos basados en nanoportadores han sido ampliamente investigados, y se han aplicado varios sistemas de administración de nanofármacos como nanopartículas, nanoliposomas y nanogeles para administrar fármacos quimioterapéuticos. Los sistemas de administración de nanofármacos pueden aumentar la solubilidad de algunos fármacos hidrófobos, al tiempo que reducen la degradación de los fármacos en la circulación corporal, y también aumentar la orientación de los fármacos y mejorar la biodisponibilidad de los fármacos mediante la liberación controlada.
El tipo de sistema de administración de nanofármacos de orientación se divide principalmente en orientación pasiva y orientación activa. Dado que el sistema vascular del sitio tumoral es más laxo en comparación con los tejidos normales, la función de eliminación de los linfocitos se ve afectada, lo que hace que algunas partículas a nanoescala se enriquezcan más fácilmente en estos tejidos, lo que constituye la orientación pasiva del sistema de nanoadministración. La orientación activa consiste en modificar los grupos de orientación, como ligandos y anticuerpos, en los nanoportadores para guiar a los nanoportadores a identificar y unirse específicamente con las células tumorales, y mediante la endocitosis recibida por el receptor, las células tumorales fagocitarán los nanoportadores, lo que dará lugar a una mayor eficacia terapéutica y orientación.
El sistema de nanoadministración dirigido activamente permite una acumulación más eficaz de agentes quimioterapéuticos en el osteosarcoma mediante la orientación de dianas expresadas específicamente en el osteosarcoma, y las dianas de alta afinidad seleccionables en el osteosarcoma se describirán a continuación.
03 Orientación activa que actúa sobre los receptores del factor de crecimiento del endotelio vascular
El crecimiento tumoral requiere un suministro sanguíneo adecuado, y la inhibición de la angiogénesis para bloquear el suministro sanguíneo puede inhibir el crecimiento tumoral. Las propias células tumorales secretan varios grupos de factores proangiogénicos, incluido el factor de crecimiento del endotelio vascular (VEGF), el factor de crecimiento derivado de plaquetas, el factor de crecimiento de fibroblastos básico, etc., y se ha demostrado que estos receptores relacionados con la angiogénesis se sobreexpresan en muchas células tumorales.
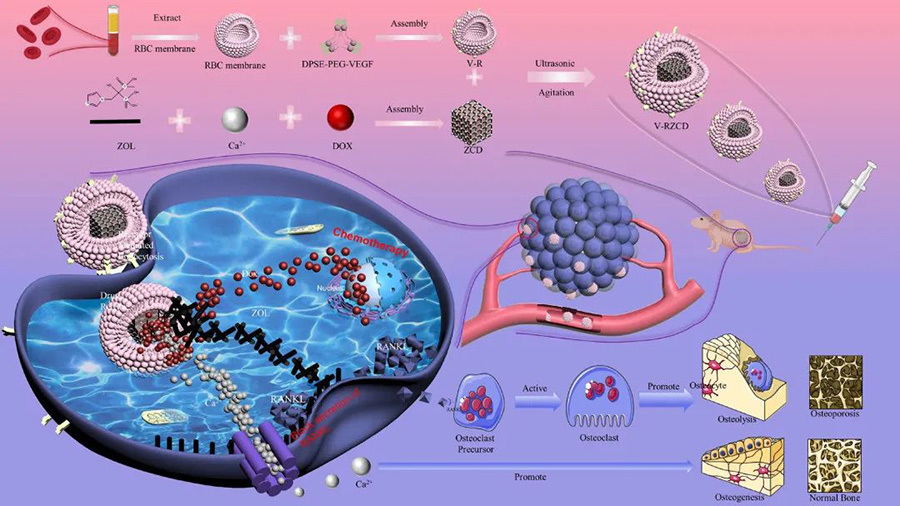
VEGFR, el receptor del VEGF, se expresa en la mayoría de las células de osteosarcoma, y se ha realizado un estudio para construir un sistema de nanoadministración utilizando la interacción del VEGF con VEGFR. Los investigadores ensamblaron una estructura metal-orgánica ZCD utilizando ácido zoledrónico, iones de calcio y adriamicina, y luego envolvieron el ZCD con membranas eritrocitarias modificadas con VEGF, nanoburbujas V-R, para formar el sistema de nanoadministración para el osteosarcoma dirigido, V-RZCD. El camuflaje de la membrana eritrocítica pudo evadir el reconocimiento del sistema inmunitario y aumentar el tiempo de retención del fármaco en la circulación somática. La estructura metal-orgánica no solo mejora el efecto antiosteolítico del ácido zoledrónico, sino que también libera iones de calcio sinérgicamente. La adriamicina en ella no solo puede utilizarse como fármaco antitumoral, sino que también puede controlar la agregación del fármaco mediante fluorescencia roja, y los resultados experimentales muestran que puede inhibir significativamente la proliferación del osteosarcoma, lo que constituye una estrategia terapéutica prometedora.
04 Orientación activa que actúa sobre las integrinas
Las proteínas integrales median el reconocimiento y la adhesión célula-célula y célula-matriz extracelular, que pueden conectar la matriz extracelular y la red esquelética intracelular como un todo, y también pueden transmitir señales extracelulares a la célula para cambiar la expresión de algunos genes en la célula. El péptido de secuencia arginina-glicina-aspartato (RGD) se une específicamente a las integrinas, y el RGD se puede utilizar para dirigir activamente el receptor de integrina αvβ3, que se expresa en gran medida en la superficie del osteosarcoma.
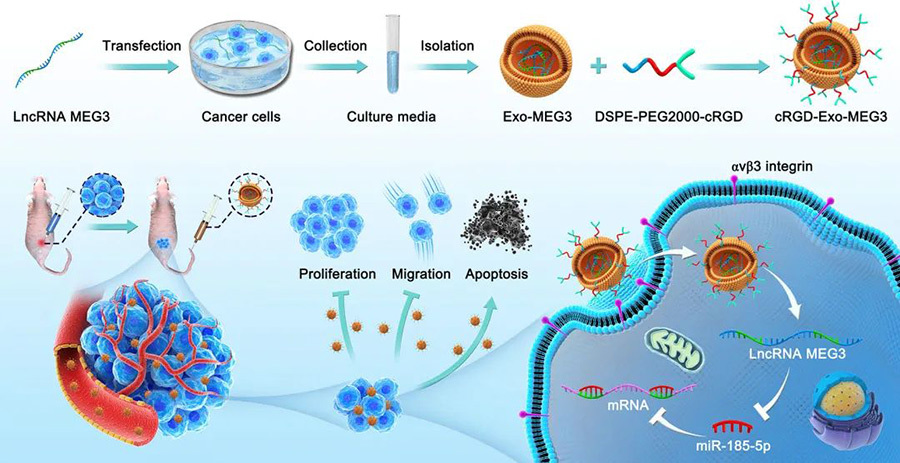
En respuesta a esta propiedad, un estudio utilizó RGD para funcionalizar exosomas ricos en lncRNA-MEG3 para construir exosomas que se dirijan activamente al osteosarcoma. Los investigadores descubrieron que el lncRNA-MEG3 podía inhibir el crecimiento de las células de osteosarcoma al dirigirse a la captación de miR-185-5p, por lo que las células tumorales se transfectaron utilizando el plásmido de expresión de lncRNA-MEG3, y el sobrenadante del cultivo celular se recogió para aislar y obtener aún más los exosomas enriquecidos con lncRNA-MEG3, y luego se modificó el RGD en la superficie de los exosomas mediante DSPE-PEG2000. Luego, se modificó el RGD en la superficie de los exosomas mediante DSPE-PEG2000 para obtener el sistema de nanoadministración de orientación activa basado en exosomas. Los resultados de los experimentos ex vivo e in vivo mostraron que la modificación del RGD mejoró la orientación de los exosomas a las células de osteosarcoma, y en comparación con los exosomas no dirigidos, los exosomas de orientación activa poseían una mayor capacidad de inhibición de la proliferación y la migración y de inducción de apoptosis, y redujeron significativamente el tamaño del osteosarcoma.
05 Orientación activa que actúa sobre los receptores de folato
El ácido fólico es un nutriente necesario para el crecimiento y la proliferación de las células humanas, y participa en la síntesis de proteínas, aminoácidos y ácidos nucleicos en el organismo. El receptor de folato es una proteína de la superficie celular con alta afinidad por el ácido fólico, que puede mediar la endocitosis y la captación de folato en el citoplasma de la célula. El receptor de folato tiene una expresión muy baja en los tejidos normales y una alta expresión en muchos tipos de células tumorales, incluido el osteosarcoma, por lo que se puede utilizar la endocitosis mediada por el receptor de folato para construir un sistema de administración de nanofármacos de orientación activa.
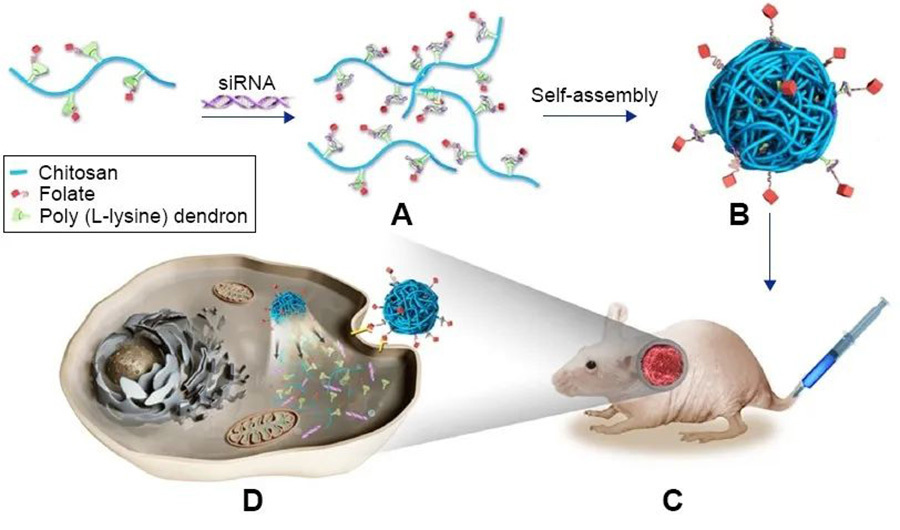
Un estudio ha desarrollado un derivado de polisacárido a nanoescala como sistema de nanoadministración para la orientación activa del osteosarcoma. Utilizando la química click, los investigadores combinaron quitosano modificado con grupo azida con polilisina ramificada modificada con alquinilo y posteriormente acoplaron ácido fólico para formar el nanoportador Cs-g-PLLD-FA, que mostró no tener citotoxicidad significativa en las evaluaciones de seguridad, y los experimentos de captación celular mostraron que la modificación del ácido fólico aumentó la captación del complejo por las células de osteosarcoma. Dado que estudios anteriores han demostrado que el gen AEG-1 se expresa en gran medida en el osteosarcoma, y la regulación a la baja de la expresión de AEG-1 puede inhibir el crecimiento del osteosarcoma, los investigadores utilizaron el nanoportador cargado con siRNA de AEG-1 y lo administraron a las células de osteosarcoma. Los resultados de los experimentos in vitro e in vivo mostraron que el sistema de nanoadministración podría regular eficazmente a la baja la expresión de AEG-1 e inhibir el crecimiento del osteosarcoma.
06 Orientación activa en el receptor adrenérgico A2
El receptor adrenérgico A2 (EphA2) es una glicoproteína transmembrana que pertenece a la familia de receptores de tirosina quinasa, y se ha demostrado que EphA2 desempeña un papel importante en el desarrollo del cáncer. A través de EphA2, se pueden afectar proteínas como la quinasa de la placa de adhesión y la proteína quinasa regulada extracelularmente para regular la proliferación y la actividad de una variedad de células tumorales malignas. EphA2 también se expresa en alta medida en la superficie de las células de osteosarcoma metastásico, y un péptido de 12 aminoácidos, el péptido YSA, tiene una afinidad muy alta por EphA2, y por lo tanto, puede unirse al péptido YSA para lograr una focalización activa. Péptido YSA para lograr una focalización activa.
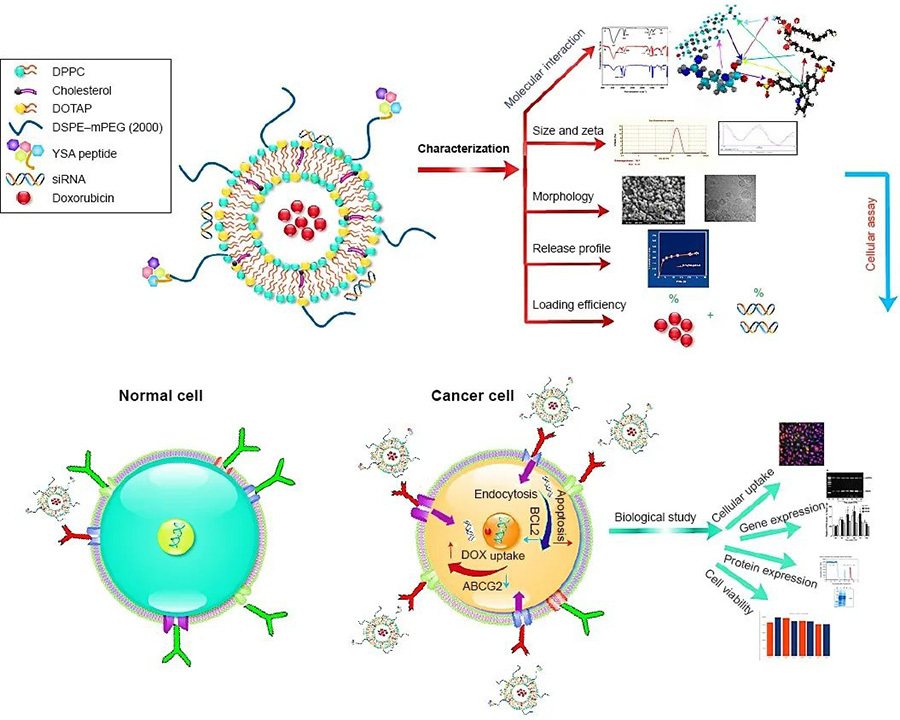
Basándose en la propiedad de focalización activa de YSA, los investigadores construyeron un nanoliposoma sensible a la temperatura y al pH para la coadministración de fármacos quimioterapéuticos y genes. En primer lugar, se sintetizaron DOTAP, colesterol, DPPC y DSPE-PEG en liposomas catiónicos que encapsulan el fármaco quimioterapéutico adriamicina, seguido de una modificación posterior del péptido YSA a la superficie de los liposomas mediante unión covalente, y finalmente la carga de JIP1-siRNA con efecto sensibilizador de la adriamicina mediante interacción de carga para obtener el nanoliposoma de focalización activa. Los resultados de los experimentos de actividad mostraron que este liposoma tenía propiedades de destrucción significativamente más altas en las células de osteosarcoma en comparación con la adriamicina libre, induciendo un 93% de apoptosis, mientras que la citotoxicidad para las células óseas normales fue significativamente menor, lo que tiene una buena perspectiva de aplicación.
07 Conclusion
El desarrollo de sistemas de nano-administración ofrece nuevas esperanzas para mejorar la seguridad y la eficacia de los fármacos mediante la administración de moléculas terapéuticas, incluidos los agentes quimioterapéuticos, los genes y otras moléculas terapéuticas, ya sea individualmente o en combinación, para lograr una capacidad precisa de destrucción del osteosarcoma; sin embargo, todavía hay margen de mejora en el estudio actual, como: la búsqueda de objetivos con mayor especificidad en el osteosarcoma, la utilización de la acción sinérgica de múltiples objetivos para mejorar la focalización y la focalización de las células tumorales circulantes en respuesta a la naturaleza fácilmente metastásica del osteosarcoma. La focalización de las células tumorales circulantes en el osteosarcoma es una característica del osteosarcoma que se metastatiza fácilmente. En conclusión, los sistemas de nano-administración ofrecen una gran esperanza para el tratamiento del osteosarcoma. Aunque estos nanomateriales emergentes todavía están en las etapas experimentales celulares y animales, creemos que la nanotecnología puede revolucionar el tratamiento clínico del osteosarcoma en un futuro próximo.


